Tiến sỹ Guido Verbeck, Phó Giáo sư hóa học tại Đại học Bắc Texas kiêm Giám đốc Phòng thí nghiệm Ghi ảnh Khối phổ, đã thiết kế các thiết bị quang học ion mới nhằm thu nhỏ, chuẩn bị và phân tích khối phổ. Ông đã phát triển một khối phổ kế bẫy ion thu nhỏ tại Phòng thí nghiệm Quốc gia Oak Ridge, ba khối phổ chuẩn bị mẫu để lọc vật liệu mới và chất xúc tác và một số ứng dụng phân tích mới đối với tế bào đơn và phân tích pháp y. Tiến sỹ Verbeck đã nhận bằng Tiến sỹ khi còn là một nghiên cứu sinh về hóa học của Proctor & Gamble tại trường Đại học Texas A&M.
Hỏi: Ông nhận thấy những thay đổi nào trong lĩnh vực MS trong thời gian gần đây?
Đáp: Sự thay đổi lớn nhất là thay vì hầu hết các chuyên gia MS đến từ các nhóm hóa hữu cơ như trước đây, hiện nay MS xuất hiện ở mọi lĩnh vực và có nhiều hơn các chuyên gia MS trong từng lĩnh vực. Về mặt thiết bị, sự thay đổi lớn nhất là ở độ nhạy. Dường như tuân theo Quy luật Moore (một thuật ngữ máy tính cho thấy sức mạnh xử lý của máy tính cứ hai năm sẽ tăng gấp đôi), độ nhạy hiện nay đã đạt tới dưới mức 10-12 và 10-15 mol/l. Sự tiến bộ này thật tuyệt vời, nó cho phép chúng ta ghi hình và làm việc với khối lượng mẫu thấp và vẫn nhận được dữ liệu tốt. Một sự thay đổi nữa là tiểu hình hóa đang giúp khối phổ kế dần nhỏ hơn với độ nhạy cao hơn.
Về mặt kỹ thuật ghép nối, dịch chuyển ion đã được cộng đồng chấp nhận như là một kỹ thuật tách cho MS thông lượng cao (IMS-MS). Với kỹ thuật ghi phổ MRM (multiple reaction monitoring) và dịch chuyển ion, có thể nhận được số lượng lớn các dữ liệu có cấu trúc rất nhanh chóng, trong cùng khoảng thời gian mà trước đó bạn chỉ có thể thu thập một quang phổ. Với dịch chuyển ion bạn có thể nhận được sự phân tách cực kỳ nhanh chóng, chỉ trong vài phần ngàn giây. Trước đây khi chỉ có các kỹ thuật tách ở trước điểm cuối của khối phổ, bạn chỉ có một khoảng thời gian nhất định để có được tất cả thông tin này trên một giải phân chất phân tích. Bây giờ, với sự dịch chuyển ion và MRM, bạn có thể nhận được hàng gigabyte dữ liệu từ cột được giải phân trong 10 hoặc 15 giây.
Hỏi: Trong số các dự án đang thực hiện, dự án nào ông thấy thú vị nhất?
Đáp: Kỹ thuật MALDI (Giải hấp/ion hóa lazer với nền mẫu) rất thú vị khi bạn không cần phải chuẩn bị mẫu nữa. Nhưng còn thú vị hơn là một bài báo được xuất bản gần đây của chúng tôi đã phân tích đơn bào thực sự sử dụng công nghệ (thao tác) nano trong MS. Chúng tôi đã tách và quan sát lipodome của một bào quan trong tế bào và thực sự tuyệt vời khi chúng tôi có thể tái lặp điều đó. Chúng tôi đã làm điều này nhờ công nghệ MS với độ nhạy đến 10-15 mol/l đã cho chúng tôi rất nhiều thông tin từ một số lượng mẫu rất nhỏ.
Hỏi: Ông có thể tiết lộ đôi chút về công nghệ nano và và dự đoán trước ảnh hưởng của nó đến các ứng dụng trong tương lai không?
Đáp: Với tổng lượng mẫu cần thực hiện ở cấp độ đơn bào, sự phân chia gần như là không thể. Bạn phải dựa vào việc tạo ra chất hóa học rất cụ thể trong các tip (tip mao dẫn kéo dài) của chất chiết nhằm có được một lớp hợp chất cụ thể có thể sử dụng được nhiều lần. Trong trường hợp của chúng tôi, đó là chất béo, và vì vậy chúng tôi sử dụng chlorofom với ammônium axêtát (một dung môi lipid thường được sử dụng với các ứng dụng của MS phun điện (electrospray)). Nếu bạn không điều chỉnh các chất hóa học, bạn sẽ trích xuất tất cả các protein, đường và mọi chất khác có trong tế bào đó. Vì vậy, chúng tôi đang sử dụng cùng một nguyên tắc như sử dụng phễu tách ngoại trừ việc chỉ thực hiện trên 1 tip duy nhất. Cách tiếp cận ở đây không phải theo phương pháp shotgun: chiết và phân tích mọi thứ. Chúng tôi phải xác định chính xác cái chúng tôi muốn thấy và phương pháp đạt được.
Hỏi: Thành tựu nào trong công cụ MS đã giúp điều này thành hiện thực?
Đáp: Những đổi mới trong công nghệ phun nano (nanospray) đã giúp chúng tôi có được 1 tip phun nano từ 1 tip chiết mao dẫn 1 micromet. Đây là một bước tiến rất lớn từ kỹ thuật MS phun điện đến phun nano. Hiệu suất ion hóa MS cũng tăng lên rất cao trong các thiết bị đo được thiết kế mới, cho phép chúng tôi thực hiện được phương pháp trên. Chúng tôi đã sử dụng kỹ thuật phun nano để chiết thuốc và dư lượng từ dấu vân tay trong các ứng dụng định pháp y.
Khối phổ kế cũng đang trở nên rẻ hơn và nhỏ hơn về kích thước, giúp chúng có thể được xách tay đến hiện trường sử dụng. Bạn có thể mua được một khối phổ kế nặng 10kg trên thị trường. Dù không toàn diện như hầu hết các khối phổ kế thiết kế để đặt cố định trên bàn thử nghiệm nhưng có lợi thế về khả năng dịch chuyển linh hoạt. Do đó, rất nhiều nhóm môi trường và pháp y đã tìm các công cụ MS hoàn toàn phù hợp với mục đích sử dụng và giá cả phải chăng.
Hỏi: Những bước đột phá tiếp theo trong MS sẽ xuất hiện ở mảng nào?
Đáp: Bước tiến lớn tiếp theo sẽ là khả năng thực hiện các phạm vi khối phổ lớn thông lượng cao với độ phân giải cao trên toàn bộ phạm vi khối phổ. Một bước đột phá khác sẽ nằm trong lĩnh vực tin học - nhận 12 gigabyte dữ liệu hình ảnh và xử lý chính xác. Chỉ mất 4 giờ để thu thập 12 gigabyte dữ liệu và mất một tuần để xử lý. Những đổi mới về cơ sở dữ liệu và tin học giúp con người sử dụng các thuật toán để đánh giá dữ liệu dựa trên những gì họ đang tìm kiếm sẽ trở nên rất quan trọng.
Hỏi: Ông có cho rằng những người sử dụng MS cần được đào tạo chuyên môn?
Đáp: Thành thật mà nói, đôi khi người ta quá tin tưởng vào các công cụ bởi tất cả các nhà cung cấp đang thiết kế chúng theo kiểu "cắm vào là chạy". Chúng tôi đã tiến hành một thử nghiệm với Cục phòng chống ma túy Hoa Kỳ (DEA) và đã thấy một số vấn đề cơ bản. Chúng tôi lấy ba khối phổ kế khác nhau và quan sát những yếu tố có thể kiểm soát được, chẳng hạn như thời gian bẫy, dòng ion hóa, khí đệm và kích thước của tế bào va chạm. Chúng tôi thấy rằng, ngay cả khi các công cụ hoạt động ở cùng một bộ điều kiện, chúng không cho kết quả tương tự. Đây có thể không là vấn đề với một người sử dụng MS như một công cụ nghiên cứu nhưng đối với DEA nó là một vấn đề lớn khi liên quan đến xác định hợp chất và đảm bảo chất lượng (QA). Do đó, tôi nghĩ rằng mỗi nhà quản lý phòng thí nghiệm cần được đào tạo cơ bản về MS và không chỉ dựa trên các cài đặt của thiết bị.
Hỏi: Sự đổi mới hiện nay trong MS có làm xuất hiện những vấn đề mới không?
Đáp: Hiện nay MS đã trở nên rất nhạy và chính xác đến mức có thể nhận thấy bất kỳ số lượng nhỏ các tạp chất hay thay đổi trong chất phản ứng do sự khác biệt giữa các lô. Người quản lý phòng thí nghiệm và các chuyên gia bảo đảm chất lượng cần phải nhận thức rõ về điều này. Chúng ta phải thường xuyên chuẩn hóa các thử nghiệm và các giao thức bởi vì đôi khi chúng ta nhận được một cột mới do một dung môi hoặc polyme thấm ra từ các ống ly tâm. Trong phân tích chất béo, chúng tôi phải rất cẩn thận vì các dung môi sử dụng có thể chiết xuất dầu và polyme từ mọi thứ, đó là lý do tại sao chúng tôi chỉ sử dụng kính. Với việc tiêm trực tiếp cho ghi ảnh MALDI, mọi kết quả đều đến từ chính mẫu. Chúng ta phải biết chính xác cái chúng ta đang tìm kiếm và sau đó thực hiện nhiều phân tích MS-MS hoặc thậm chí MS-MS-MS để xác định kết quả chúng ta đưa ra là chính xác.
Hỏi: Có bất kỳ bẫy dẫn đến sai sót nào mà nhà quản lý phòng thí nghiệm nên tránh?
Đáp: Một điều chúng tôi đã nhận thấy về mặt chiết tách là tất cả mọi người đều sử dụng cột sắc ký khí (GC) và sắc ký lỏng (LC) mới. Vì độ nhạy được cải thiện của MS, chúng ta nhận thấy các hiện tượng chảy máu cột (bleeding) khác nhau. Không phải tất cả các cột đều giống nhau, do đó, chúng ta không thể nhắm mắt chọn hai cột bất kỳ và mong đợi chúng thực hiện tương tự. Sự ổn định cột không phù hợp với độ nhạy của máy quang phổ khối. Vì vậy, các nhà quản lý phòng thí nghiệm nên tìm mua các cột giống nhau và chạy chúng trong cùng điều kiện. Điều này làm cho các quy trình vận hành tiêu chuẩn (SOPs) của chúng ta dài hơn nhưng chúng ta phải kiểm soát tất cả các yếu tố để có thể đảm bảo dữ liệu nhận được là đúng.
Hỏi: Ông tìm kiếm tư vấn và giúp đỡ từ những nguồn nào?
Đáp: Nơi đầu tiên chúng tôi tìm đến là một phòng thí nghiệm đã thành công trước đó để có được quy trình vận hành tiêu chuẩn (SOPs) của họ và xây dựng các giao thức của chúng tôi dựa trên kết quả nhất quán của họ. Điều này tốt hơn là chỉ dựa vào tài liệu, nơi đôi khi không thể sao chép những gì đã được thực hiện. Bạn cũng có thể tìm tới nhà cung cấp công cụ và tìm kiếm sự giúp đỡ từ các nhà khoa học ứng dụng của họ. Công việc của họ là giúp giải quyết các vấn đề của khách hàng, và rất có khả năng họ đã gặp vấn đề này trước đây, do đó có thể giúp bạn khắc phục sự cố.
Hoài Anh dịch (Theo www.labmanager.com)


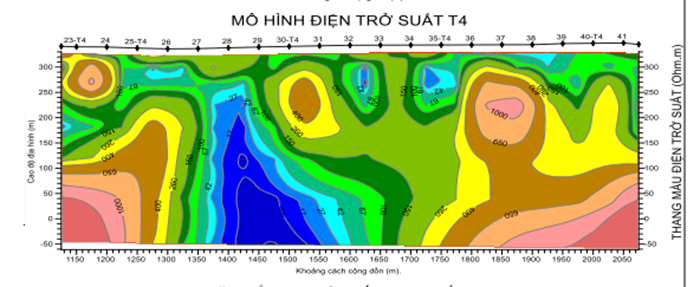



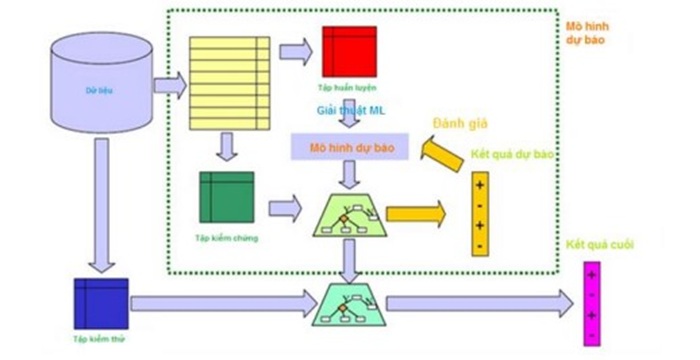





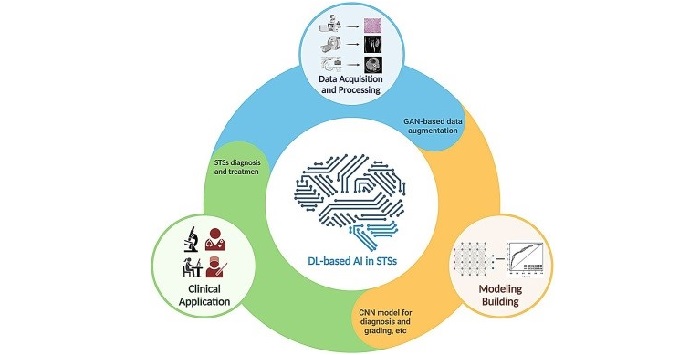





![[VIDEO] Hội thảo “Chất lượng nước – Những kỹ thuật mới nhất trong đảm bảo và kiểm soát chất lượng”](/resize/363/thu-vien-anh/hoi-thao-chat-luong-nuoc-vinalab-jaima-2024-12x363x4.jpg)


