Trong phân tích hóa học, sắc ký là một kỹ thuật phòng thí nghiệm để tách hỗn hợp (mixture) thành các thành phần của nó. Hỗn hợp được hòa tan trong dung môi lỏng (fluid solvent dạng khí hoặc lỏng) được gọi là pha động (mobile phase), pha động này mang nó qua một hệ thống (cột, ống mao dẫn, đĩa hoặc tấm) trên đó vật liệu được gọi là pha tĩnh (stationary phase) và nó cố định. Bởi vì các thành phần khác nhau của hỗn hợp có xu hướng có các ái lực khác nhau đối với pha tĩnh và được giữ lại trong các khoảng thời gian khác nhau tùy thuộc vào tương tác của chúng với các vị trí bề mặt, các thành phần di chuyển với vận tốc biểu kiến khác nhau trong chất lỏng di động, khiến chúng tách ra. Sự phân tách dựa trên sự phân vùng khác biệt giữa pha động và pha tĩnh. Sự khác biệt nhỏ trong hệ số phân vùng (partition coefficient) của một hợp chất dẫn đến sự duy trì chênh lệch trên pha tĩnh và do đó ảnh hưởng đến sự phân tách.
1. Sắc ký là gì?
Sắc ký tiếng Anh là Chromatography, được phát âm là /ˌkroʊməˈtɒɡrəfi/, có nguồn gốc từ tiếng Hy Lạp “χρῶμα - chroma” có nghĩa là màu sắc và “γράφειν - graphein” có nghĩa là viết. Sự kết hợp của hai thuật ngữ này được kế thừa trực tiếp từ việc phát minh ra kỹ thuật được sử dụng để tách các chất màu. Sắc ký là một trong các kĩ thuật phân tích thường dùng trong phòng thí nghiệm của bộ môn hóa học phân tích dùng để tách các chất trong một hỗn hợp.
Sắc ký được được chia làm 2 loại là sắc ký điều chế và sắc ký phân tích. Mục đích của sắc ký điều chế (preparative chromatography) là tách các thành phần của hỗn hợp, do đó nó được coi là một dạng tinh chế. Quá trình này thường có chi phí cao hơn do phương thức sản xuất đặc thù của nó. Sắc ký phân tích (analytical chromatography) được thực hiện với lượng vật liệu nhỏ hơn, được dùng để thiết lập sự hiện diện hoặc đo tỷ lệ tương đối của các chất phân tích trong một hỗn hợp. Hai loại này không loại trừ lẫn nhau.

Sắc ký là gì?
2. Lịch sử hình thành của phương pháp sắc ký
Phương pháp sắc ký được nhà khoa học người Ý là Mikhail Tsvet phát minh ra lần đầu tiên ở Nga vào năm 1900. Ông đã phát triển kỹ thuật và đặt ra thuật ngữ sắc ký vào thập kỷ đầu tiên của thế kỷ 20, chủ yếu để tách các sắc tố thực vật như diệp lục, carotenes và xanthophylls. Vì các thành phần này phân tách thành các dải màu khác nhau (tương ứng là xanh lá cây, cam và vàng) nên chúng đã trực tiếp tạo cảm hứng cho tên gọi của kỹ thuật sắc ký. Các kiểu sắc ký mới được phát triển trong những năm 1930 và 1940 đã làm cho kỹ thuật này trở nên hữu ích cho nhiều quá trình phân tách.
Kỹ thuật sắc ký là kết quả của công trình nghiên cứu của Archer John Porter Martin và Richard Laurence Millington Synge trong suốt những năm 1940 và 1950, nhờ đó họ đã giành được giải Nobel Hóa học năm 1952. Họ đã thiết lập các nguyên tắc và kỹ thuật cơ bản của sắc ký phân vùng và công việc của họ đã khuyến khích sự phát triển nhanh chóng của một số phương pháp sắc ký: sắc ký giấy, sắc ký khí và sắc ký lỏng hiệu năng cao .Kể từ đó, phương pháp này đã phát triển nhanh chóng. Các nhà nghiên cứu nhận thấy rằng các nguyên tắc chính của sắc ký Tsvet có thể được áp dụng theo nhiều cách khác nhau. Những tiến bộ đang liên tục cải thiện hiệu suất kỹ thuật của sắc ký, cho phép tách các cả những phân tử gần như giống nhau.
3. Các thuật ngữ trong kỹ thuật sắc ký
Chất phân tích (Analyte) là chất được tách ra trong quá trình sắc ký. Nó là chất cần thiết được tách ra từ các hỗn hợp.
Sắc ký phân tích (Analytical chromatography) là việc sử dụng sắc ký để xác định sự tồn tại và cả nồng độ của các chất phân tích trong một mẫu.
Pha liên kết (Bonded phase) là pha tĩnh được liên kết cộng hóa trị với các hạt đỡ hoặc với thành bên trong của ống cột.
Sắc ký đồ (Chromatogram) là đầu ra trực quan của máy sắc ký. Trong trường hợp phân tách tối ưu, các pic hoặc dạng khác nhau trên sắc ký đồ tương ứng với các thành phần khác nhau của hỗn hợp được tách.
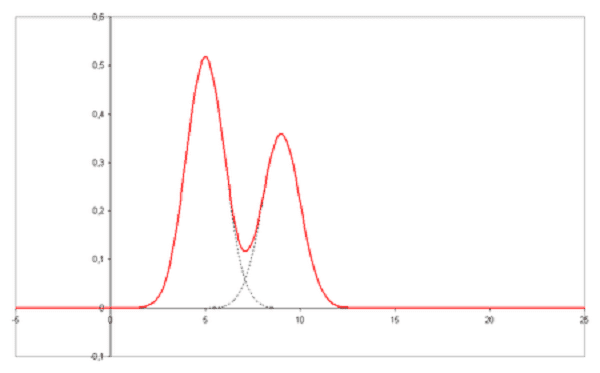
Sắc đồ với các đỉnh chưa được giải quyết Sắc đồ với hai đỉnh đã phân giải
Trong đó: Biểu đồ trên trục x là thời gian lưu và vẽ trên trục y một tín hiệu (ví dụ thu được bằng máy quang phổ, máy khối phổ, khối phổ kế hoặc nhiều loại máy dò khác) tương ứng với phản ứng tạo ra bởi chất phân tích ra khỏi hệ thống. Trong trường hợp của một hệ thống tối ưu, tín hiệu tỷ lệ với nồng độ của chất phân tích cụ thể được tách ra.
Máy sắc ký (Chromatograph) là một thiết bị cho phép phân tách một cách rất tinh vi, ví dụ như tách sắc ký khí hoặc sắc ký lỏng.
Sắc ký (Chromatography) là một phương pháp phân tách vật lý phân bố các thành phần để phân tách giữa hai pha, một pha tĩnh và pha động chuyển động theo một hướng xác định.
Chất rửa giải (Eluent) là dung môi hoặc chất cố định dung môi được sử dụng trong sắc ký rửa giải và tương ứng với pha động.
Rửa giải (Eluate) là hỗn hợp của chất tan (solute) và dung môi (solvent) thoát ra khỏi cột.
Nước thải (Effluent) là dòng chảy ra khỏi cột sắc ký. Trong thực tế, nó được sử dụng tương tự như rửa giải, nhưng thuật ngữ này chính xác hơn đề cập đến dòng chảy độc lập với sự phân tách diễn ra.
Eluite là một thuật ngữ để chỉ chất tan hoặc chất phân tích. Nó là thành phần mẫu rời khỏi cột sắc ký.
Dòng Eluotropic (Eluotropic series) là danh sách các dung môi được xếp hạng theo khả năng rửa giải của chúng.
Pha cố định (Immobilized phase) là pha tĩnh cố định trên các hạt đỡ hoặc trên thành trong của ống cột.
Pha động (mobile phase) là pha di chuyển theo một hướng xác định. Nó có thể là chất lỏng (LC và sắc ký điện mao quản - capillary electrochromatography - CEC), chất khí (GC), hoặc chất lỏng siêu tới hạn (sắc ký chất lỏng siêu tới hạn - supercritical-fluid chromatography - SFC). Pha động bao gồm mẫu được tách/phân tích và dung môi di chuyển mẫu qua cột. Trong trường hợp HPLC, pha động bao gồm các dung môi không phân cực như hexan trong pha thường hoặc dung môi phân cực như methanol trong sắc ký pha đảo và mẫu được tách. Pha động di chuyển qua cột sắc ký (pha tĩnh) tại đây mẫu tương tác với pha tĩnh và được tách ra.
Sắc ký điều chế (Preparative chromatography) là việc sử dụng sắc ký để tinh chế đủ lượng chất để sử dụng tiếp thay vì chỉ dùng để phân tích.
Thời gian lưu (Retention time) là thời gian đặc trưng cần thiết để một chất phân tích cụ thể đi qua hệ thống (từ đầu vào cột đến đầu dò) trong các điều kiện đã đặt.
Mẫu (Sample) là chất được phân tích trong sắc ký. Nó có thể bao gồm một thành phần đơn lẻ hoặc có thể là một hỗn hợp của các thành phần. Khi mẫu được xử lý trong quá trình phân tích, pha hoặc các pha chứa chất phân tích được quan tâm gọi là mẫu, trong khi những thứ không được quan tâm được tách ra khỏi mẫu trước hoặc trong quá trình phân tích gọi là như chất thải.
Chất tan (Solute) là các thành phần mẫu trong sắc ký phân vùng.
Dung môi (Solvent) là bất kỳ chất nào có khả năng hòa tan một chất khác và đặc biệt là pha động lỏng trong sắc ký lỏng.
Pha tĩnh (Stationary phase) là chất được cố định tại chỗ cho quy trình sắc ký. Ví dụ như lớp silica trong sắc ký lớp mỏng.
Máy dò (Detector) là dụng cụ được sử dụng để phát hiện định tính và định lượng các chất phân tích sau khi tách.
Sắc ký dựa trên khái niệm hệ số phân vùng. Bất kỳ chất tan nào phân vùng giữa hai dung môi không hòa tan. Khi chúng ta làm cho một dung môi này bất động (bằng cách hấp phụ trên nền hỗ trợ rắn) và một dung môi khác di động, nó dẫn đến hầu hết các ứng dụng phổ biến của sắc ký. Nếu chất nền hoặc pha tĩnh là phân cực (ví dụ: giấy, silica, v.v.) thì đó là sắc ký pha thuận và nếu không phân cực (C-18) thì đó là pha đảo ngược.
4. Kỹ thuật sắc ký dạng luống
4.1. Kỹ thuật sắc ký cột (Column chromatography)
Sắc ký cột là một kỹ thuật tách trong đó lớp tĩnh nằm trong một ống. Các hạt của pha tĩnh rắn hoặc chất hỗ trợ được phủ bởi pha tĩnh lỏng có thể lấp đầy toàn bộ thể tích bên trong của ống (cột được đóng gói) hoặc tập trung trên hoặc dọc theo thành ống bên trong để lại một đường mở, không hạn chế cho pha động trong phần giữa của ống (cột hình ống hở). Sự khác biệt về tốc độ di chuyển qua môi trường được tính cho các thời gian lưu khác nhau của mẫu. Năm 1978, W. Clark Still giới thiệu một phiên bản cải tiến của sắc ký cột được gọi là sắc ký cột chớp cháy (flash). Kỹ thuật này rất giống với sắc ký cột truyền thống, ngoại trừ việc dung môi được dẫn qua cột bằng cách tạo áp suất dương. Điều này cho phép hầu hết các phân tách được thực hiện trong vòng chưa đầy 20 phút, các phân tách đều được cải thiện so với phương pháp cũ. Các hệ thống sắc ký nhanh hiện đại được bán dưới dạng hộp mực nhựa đóng gói sẵn và dung môi được bơm qua hộp mực. Các hệ thống cũng có thể được liên kết với máy dò và bộ thu thập phân số để tự động hóa. Sự ra đời của máy bơm gradientt dẫn đến việc phân tách nhanh hơn và sử dụng ít dung môi hơn.
Trong hấp phụ tầng mở rộng, tầng sôi được sử dụng thay vì pha rắn được tạo bởi tầng đóng gói. Điều này cho phép bỏ qua các bước làm sạch ban đầu như ly tâm và lọc, đối với nước dùng nuôi cấy hoặc bùn của các tế bào bị hỏng.
Sắc ký phosphocellulose sử dụng ái lực liên kết của nhiều protein liên kết DNA đối với phosphocellulose. Tương tác của protein với DNA càng mạnh thì nồng độ muối cần thiết để rửa giải protein đó càng cao.
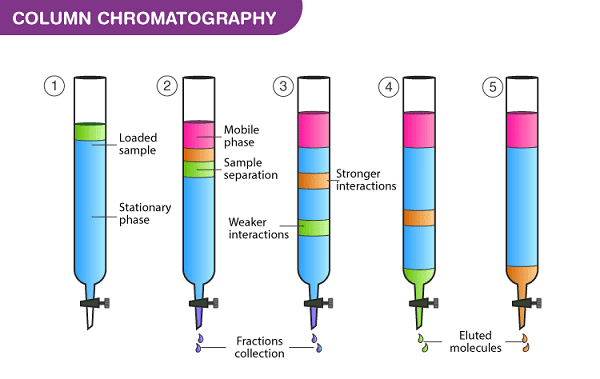
Biểu đồ kỹ thuật sắc ký cột
4.2. Sắc ký phẳng (Planar chromatography)
Sắc ký phẳng là một kỹ thuật tách trong đó pha tĩnh có mặt dưới dạng hoặc trên một mặt phẳng. Mặt phẳng có thể là một tờ giấy, dùng như vậy hoặc được tẩm chất làm lớp tĩnh (sắc ký giấy) hoặc một lớp các hạt rắn trải trên một giá đỡ như tấm kính (sắc ký lớp mỏng). Các hợp chất khác nhau trong hỗn hợp mẫu di chuyển những quãng đường khác nhau tùy theo mức độ chúng tương tác mạnh với pha tĩnh so với pha động. Hệ số lưu giữ cụ thể (Rf) của mỗi hóa chất có thể được sử dụng để hỗ trợ việc xác định một chất chưa biết.
a. Phương pháp sắc ký giấy (Paper chromatography)
Sắc ký giấy là một kỹ thuật bao gồm việc đặt một chấm nhỏ hoặc dòng dung dịch mẫu lên một dải giấy sắc ký. Giấy được đặt trong một thùng có một lớp dung môi nông và được đậy kín. Khi dung môi chảy qua giấy, nó gặp hỗn hợp mẫu, bắt đầu di chuyển lên giấy cùng với dung môi. Giấy này được làm bằng xenlulo, một chất phân cực và các hợp chất trong hỗn hợp sẽ di chuyển xa hơn nếu chúng ít phân cực hơn. Các chất phân cực hơn liên kết với giấy xenlulo nhanh hơn và do đó không di chuyển xa.
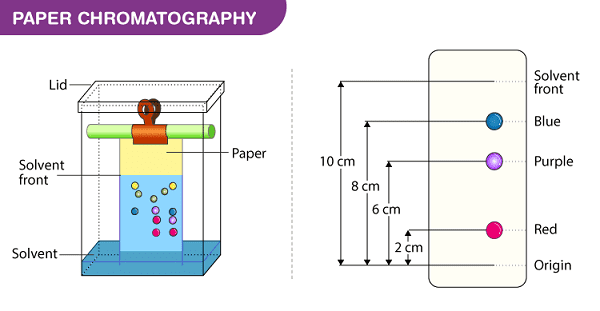
Biểu đồ phương pháp sắc ký giấy
b. Phương pháp sắc ký lớp mỏng (Thin-layer chromatography - TLC)
Sắc ký lớp mỏng (TLC) là một kỹ thuật phòng thí nghiệm được sử dụng rộng rãi được sử dụng để tách các chất hóa sinh khác nhau trên cơ sở các điểm hấp dẫn tương đối của chúng đối với pha tĩnh và pha động. Nó tương tự như sắc ký giấy. Tuy nhiên, thay vì sử dụng pha tĩnh của giấy, nó bao gồm pha tĩnh của một lớp chất hấp phụ mỏng như silica gel, alumin hoặc xenluloza trên một nền phẳng, trơ.
TLC rất linh hoạt, nhiều mẫu có thể được tách đồng thời trên cùng một lớp, rất hữu ích cho các ứng dụng sàng lọc như kiểm tra nồng độ thuốc và độ tinh khiết của nước. Khả năng lây nhiễm chéo thấp vì mỗi lần tách được thực hiện trên một lớp mới.
So với sắc ký giấy, nó có ưu điểm là chạy nhanh hơn, phân tách tốt hơn, phân tích định lượng tốt hơn và có thể lựa chọn giữa các chất hấp phụ khác nhau. Để có độ phân giải tốt hơn và tách nhanh hơn mà sử dụng ít dung môi hơn, có thể sử dụng TLC hiệu suất cao. Một cách sử dụng phổ biến trước đây là phân biệt các nhiễm sắc thể bằng cách quan sát khoảng cách trong gel (tách là một bước riêng biệt).
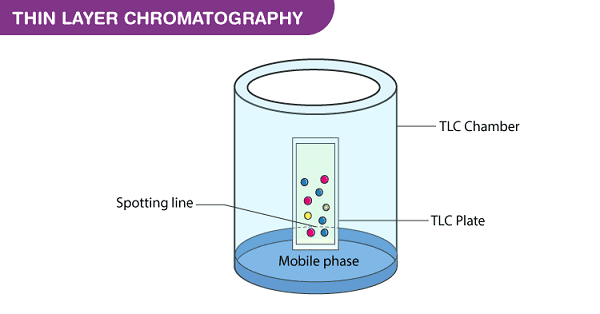
Biểu đồ phương pháp sắc ký lớp mỏng
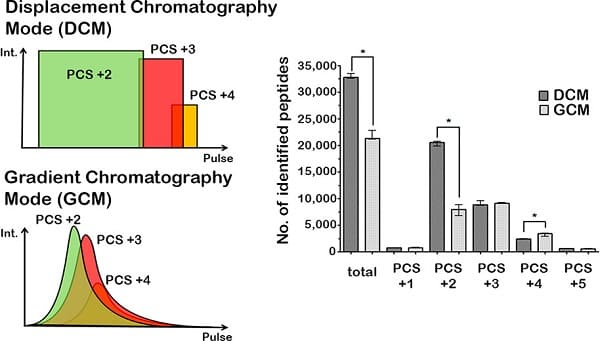
5. Phương pháp sắc ký chuyển vị (Displacement chromatography)
Nguyên tắc cơ bản của sắc ký chuyển vị là: Một phân tử có ái lực cao với chất nền sắc ký (chất chuyển vị) cạnh tranh hiệu quả với các vị trí liên kết và thay thế các phần tử có ít ái lực hơn. Có sự khác biệt rõ ràng giữa sắc ký chuyển vị và sắc ký rửa giải.
Biểu đồ phương pháp sắc ký chuyển vị
Trong chế độ rửa giải, các chất thường xuất hiện từ một cột trong các pic Gaussian hẹp. Cần có sự phân tách rộng của các pic để đạt được độ tinh khiết tối đa, tốt nhất là so với đường nền. Tốc độ mà bất kỳ thành phần nào của hỗn hợp di chuyển xuống cột ở chế độ rửa giải đều phụ thuộc vào nhiều yếu tố. Nhưng để 2 chất di chuyển với tốc độ khác nhau được phân giải thì phải có sự khác biệt đáng kể trong một số tương tác giữa các phân tử sinh học và nền sắc ký. Các thông số vận hành được điều chỉnh để tối đa hóa tác dụng của sự khác biệt này. Trong nhiều trường hợp, chỉ có thể đạt được sự phân tách đường cơ sở của các pic khi rửa giải bằng gradient và tải trọng cột thấp. Do đó, hạn chế đối với sắc ký chế độ rửa giải là sự phức tạp trong hoạt động, đặc biệt là ở quy mô điều chế do bơm dung môi gradientt, thông lượng thấp, tải cột thấp.
Sắc ký chuyển vị có ưu điểm hơn sắc ký rửa giải ở chỗ các thành phần được phân giải thành các vùng liên tiếp sẽ tinh khiết hơn là các "peaks". Bởi vì quá trình tận dụng lợi thế của sự phi tuyến tính của các đường đẳng nhiệt, nguồn cấp dữ liệu cột lớn hơn có thể được tách ra trên một cột nhất định với các thành phần tinh khiết được thu hồi ở nồng độ cao hơn đáng kể.
6. Kỹ thuật sắc ký theo trạng thái vật lý của pha động
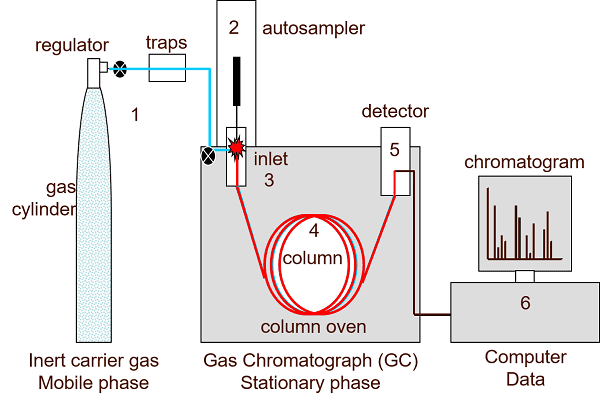
6.1. Phương pháp sắc ký khí (Gas chromatography)
Sắc ký khí (GC) đôi khi còn được gọi là sắc ký khí-lỏng (gas-liquid chromatography - GLC), là một kỹ thuật tách trong đó pha động là một chất khí. Sự phân tách sắc ký khí luôn được thực hiện trong một cột, cột này thường được đóng gói hoặc mao quản. Cột đóng gói là công việc thường xuyên của sắc ký khí, rẻ hơn, dễ sử dụng hơn và thường cho hiệu suất phù hợp. Các cột mao quản thường cho độ phân giải vượt trội hơn nhiều và mặc dù đắt tiền hơn nhưng đang được sử dụng rộng rãi, đặc biệt là đối với các hỗn hợp phức tạp. Hơn nữa, cột mao quản có thể được chia thành ba lớp: cột hình ống hở có lớp xốp (porous layer open tubular - PLOT), cột hình ống hở có phủ tường (wall-coated open tubular - WCOT) và cột hình ống hở có phủ lớp hỗ trợ (support-coated open tubular - SCOT). Cột PLOT là duy nhất theo cách mà pha tĩnh được hấp thụ vào thành cột, trong khi cột WCOT có pha tĩnh được liên kết hóa học với thành. Cột SCOT là sự kết hợp của hai loại, chúng có các hạt hỗ trợ dính vào thành cột, nhưng các hạt đó có pha lỏng liên kết hóa học với chúng. Cả hai loại cột này đều được làm từ vật liệu không hấp phụ và trơ về mặt hóa học. Thép không gỉ và thủy tinh là những vật liệu thông thường cho các cột được đóng gói và thạch anh hoặc silica nung chảy cho các cột mao quản.
Biểu đồ phương pháp sắc ký khí
Sắc ký khí dựa trên sự cân bằng phân chia của chất phân tích giữa pha tĩnh lỏng rắn hoặc nhớt (thường là vật liệu gốc silicone lỏng) và khí di động (thường là heli). Pha tĩnh được dính vào bên trong của ống thủy tinh hoặc ống silica nung chảy có đường kính nhỏ (thường là 0,53 - 0,18mm) (cột mao quản) hoặc chất nền rắn bên trong ống kim loại lớn hơn (cột được đóng gói). Nó được sử dụng rộng rãi trong hóa học phân tích; mặc dù nhiệt độ cao được sử dụng trong GC làm cho nó không phù hợp với các chất tạo phân tử hoặc protein có trọng lượng phân tử cao (nhiệt làm biến tính chúng) thường gặp trong hóa sinh, nhưng nó rất thích hợp để sử dụng trong hóa dầu, giám sát môi trường và các lĩnh vực xử lý và hóa chất công nghiệp. Nó cũng được sử dụng nhiều trong nghiên cứu hóa học.
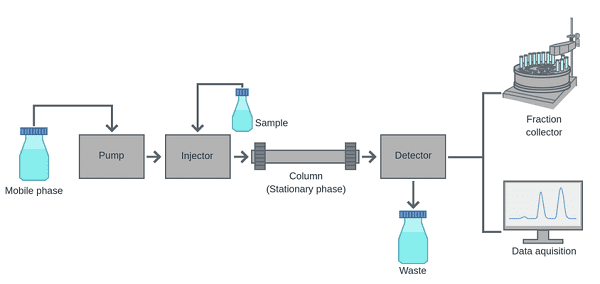
6.2. Phương pháp sắc ký lỏng (Liquid chromatography)
Sắc ký lỏng (LC) là một kỹ thuật tách trong đó pha động là chất lỏng. Nó có thể được thực hiện trong một cột hoặc một mặt phẳng. Sắc ký lỏng ngày nay thường sử dụng các hạt đóng gói rất nhỏ và áp suất tương đối cao được gọi là sắc ký lỏng hiệu năng cao (high-performance liquid chromatography - HPLC).
Biểu đồ phương pháp sắc ký lỏng
Trong HPLC, mẫu được ép bởi chất lỏng ở áp suất cao (pha động) qua một cột chứa pha tĩnh bao gồm các hạt có hình dạng không đều hoặc hình cầu, một lớp xốp nguyên khối hoặc một màng xốp. Nguyên khối là "phương tiện sắc ký giống như bọt biển" và được tạo thành từ một khối vô cơ hoặc hữu cơ không liên kết. Trong lịch sử, HPLC được chia thành hai phân lớp khác nhau dựa trên phân cực của pha động và pha tĩnh. Các phương pháp trong đó pha tĩnh phân cực hơn pha động (ví dụ, toluen làm pha động, silica làm pha tĩnh) được gọi là sắc ký lỏng pha bình thường (normal phase liquid chromatography - NPLC) và ngược lại (ví dụ, hỗn hợp nước-methanol làm chất di động. phase và C18 octadecylsilyl như pha tĩnh) được gọi là sắc ký lỏng pha đảo ngược (reversed phase liquid chromatography - RPLC).
7. Kỹ thuật sắc ký ái lực (Affinity chromatography)
Sắc ký ái lực dựa trên tương tác không cộng hóa trị có chọn lọc giữa chất phân tích và các phân tử cụ thể. Nó rất cụ thể, nhưng không mạnh mẽ lắm. Nó thường được sử dụng trong hóa sinh để tinh chế các protein liên kết với thẻ. Các protein dung hợp này được gắn nhãn với các hợp chất như thẻ His, biotin hoặc kháng nguyên, liên kết đặc biệt với pha tĩnh. Sau khi tinh chế, các thẻ này thường được loại bỏ và thu được protein tinh khiết.

Biểu đồ kỹ thuật sắc ký ái lực
Sắc ký ái lực thường sử dụng ái lực của phân tử sinh học với kim loại (Zn, Cu, Fe, v.v.). Các cột thường được chuẩn bị thủ công. Các cột ái lực truyền thống được sử dụng như một bước chuẩn bị để loại bỏ các phân tử sinh học không mong muốn.
Tuy nhiên, các kỹ thuật sắc ký lỏng tồn tại sử dụng các đặc tính của sắc ký ái lực. Sắc ký ái lực kim loại cố định (Immobilized metal affinity chromatography - IMAC) rất hữu ích để tách các phân tử nói trên dựa trên ái lực tương đối với kim loại. Thường thì các cột này có thể được tải bằng các kim loại khác nhau để tạo ra một cột có sở thích được nhắm mục tiêu.
7.1. Sắc ký chất lỏng siêu tới hạn (Supercritical fluid chromatography)
Sắc ký chất lỏng siêu tới hạn là một kỹ thuật tách trong đó pha động là chất lỏng ở trên và tương đối gần với nhiệt độ và áp suất tới hạn của nó.
8. Các kỹ thuật sắc ký theo cơ chế tách
8.1. Phương pháp sắc ký trao đổi ion (Ion exchange chromatography)
Sắc ký trao đổi ion (thường được gọi là sắc ký ion) sử dụng cơ chế trao đổi ion để phân tách các chất phân tích dựa trên các điện tích tương ứng của chúng. Nó thường được thực hiện trong các cột nhưng cũng có thể hữu ích trong chế độ phẳng. Sắc ký trao đổi ion sử dụng pha tĩnh tích điện để tách các hợp chất tích điện bao gồm anion, cation, axit amin, peptit và protein. Trong các phương pháp thông thường, pha tĩnh là một loại nhựa trao đổi ion mang các nhóm chức tích điện tương tác với các nhóm tích điện trái dấu của hợp chất để giữ lại. Có hai loại sắc ký trao đổi ion: Cation-Exchange và Anion-Exchange. Trong Sắc ký trao đổi Cation, pha tĩnh có điện tích âm và ion có thể trao đổi là cation, trong khi sắc ký trao đổi anion, pha tĩnh có điện tích dương và ion có thể trao đổi là anion. Sắc ký trao đổi ion thường được sử dụng để tinh sạch protein bằng FPLC.

Biểu đồ phương pháp sắc ký trao đổi ion
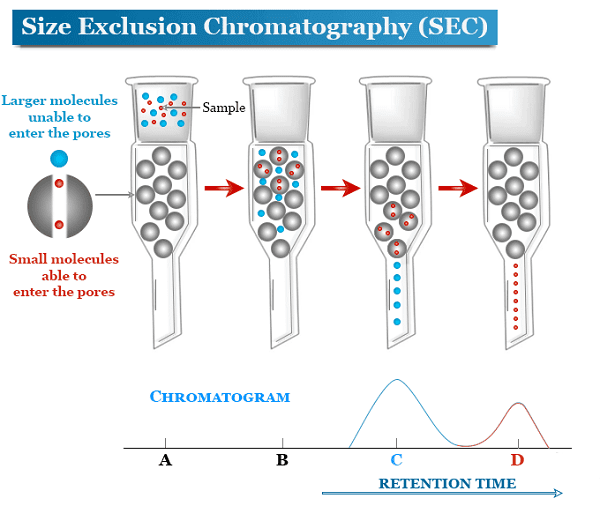
8.2. Phương pháp sắc ký loại trừ kích thước (Size-exclusion chromatography)
Sắc ký loại trừ kích thước (SEC) còn được gọi là sắc ký thẩm thấu gel (gel permeation chromatography - GPC) hoặc sắc ký lọc gel và phân tách các phân tử theo kích thước của chúng (hay chính xác hơn là theo đường kính thủy động hoặc thể tích thủy động của chúng). Các phân tử nhỏ hơn có thể đi vào các lỗ của môi trường. do đó, các phân tử bị giữ lại và loại bỏ khỏi dòng chảy của pha động. Thời gian lưu trú trung bình trong lỗ xốp phụ thuộc vào kích thước hiệu quả của các phân tử chất phân tích. Tuy nhiên, các phân tử lớn hơn kích thước lỗ trung bình của bao bì bị loại trừ và do đó về cơ bản không bị giữ lại; những loài như vậy là những loài đầu tiên được rửa giải. Nó thường là một kỹ thuật sắc ký có độ phân giải thấp và do đó nó thường được dành cho bước "đánh bóng" cuối cùng của quá trình tinh chế. Nó cũng hữu ích để xác định cấu trúc bậc ba và cấu trúc bậc bốn protein tinh khiết, đặc biệt là vì nó có thể được thực hiện trong các điều kiện dung dịch tự nhiên.
Biểu đồ phương pháp sắc ký loại trừ kích thước
8.3. Phương pháp tách sắc ký hấp phụ lớp mở rộng
Cột hấp phụ sắc ký tầng mở rộng (expanded bed chromatographic adsorption - EBA) cho quy trình phân tách sinh hóa bao gồm bộ phân phối chất lỏng cân bằng áp suất có chức năng tự làm sạch bên dưới tấm sàng chặn xốp ở dưới đáy của tầng mở rộng, cụm vòi phun phần trên có chức năng làm sạch bụi bẩn ngược ở phía trên cùng của lớp đệm mở rộng, sự phân phối tốt hơn của chất lỏng nguyên liệu được thêm vào lớp đệm mở rộng đảm bảo rằng chất lỏng đi qua lớp đệm mở rộng hiển thị trạng thái của dòng chảy piston. Lớp tầng mở rộng hiển thị trạng thái của dòng chảy piston. Cột tách sắc ký tầng mở rộng có ưu điểm là tăng hiệu quả phân tách của tầng mở rộng.
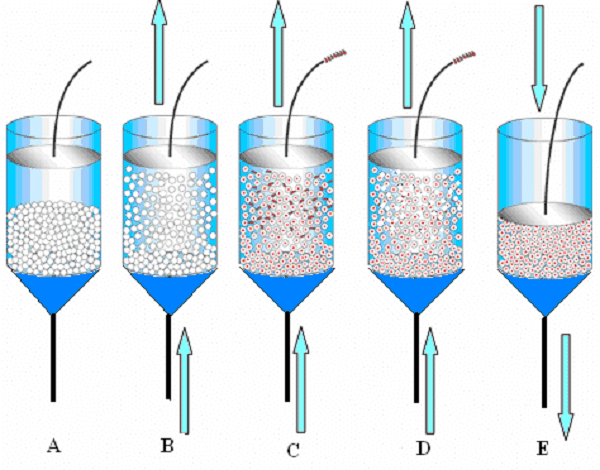
Biểu đồ phương pháp tách sắc ký hấp phụ lớp mở rộng
Sắc ký hấp phụ lớp mở rộng (EBA) là một kỹ thuật thuận tiện và hiệu quả để thu giữ các protein trực tiếp từ mẫu thô chưa phân tích. Trong sắc ký EBA, lớp lắng đầu tiên được mở rộng bởi dòng chảy lên của đệm cân bằng. Thức ăn thô, một hỗn hợp của protein hòa tan, chất gây ô nhiễm, tế bào và mảnh vụn tế bào, sau đó được chuyển lên trên qua lớp đệm mở rộng. Các protein mục tiêu được bắt giữ trên chất hấp phụ, trong khi các hạt và chất gây ô nhiễm đi qua. Việc thay đổi dung dịch đệm rửa giải trong khi vẫn duy trì dòng chảy lên dẫn đến việc giải hấp protein mục tiêu ở chế độ tầng mở rộng. Ngoài ra, nếu dòng chảy bị đảo ngược, các phần tử bị hấp phụ sẽ nhanh chóng lắng xuống và các protein có thể được khử hấp thụ bằng dung dịch đệm rửa giải. Chế độ được sử dụng để rửa giải (tầng mở rộng so với tầng lắng) phụ thuộc vào các đặc tính của nguồn cấp dữ liệu. Sau khi rửa giải, chất hấp phụ được làm sạch bằng dung dịch làm sạch tại chỗ (cleaning-in-place - CIP) được xác định trước, sau đó làm sạch bằng cách tái sinh cột (để sử dụng tiếp) hoặc bảo quản.
9. Những kỹ thuật sắc ký đặc biệt
9.1. Phương pháp sắc ký pha đảo ngược (Reversed-phase chromatography)
Sắc ký pha đảo ngược (RPC) là bất kỳ quy trình sắc ký lỏng nào trong đó pha động phân cực hơn đáng kể so với pha tĩnh. Nó được đặt tên như vậy bởi vì trong sắc ký lỏng pha thường, pha động ít phân cực hơn nhiều so với pha tĩnh. Các phân tử kỵ nước trong pha động có xu hướng hấp phụ vào pha tĩnh tương đối kỵ nước. Các phân tử ưa nước trong pha động sẽ có xu hướng rửa giải trước. Cột tách thường bao gồm chuỗi cacbon C8 hoặc C18 được liên kết với chất nền hạt silica.
Biểu đồ phương pháp sắc ký pha đảo ngược
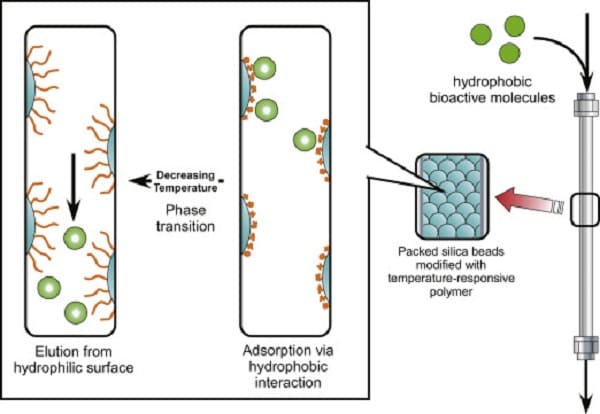
9.2. Phương pháp sắc ký tương tác kỵ nước (Hydrophobic interaction chromatography)
Sắc ký tương tác kỵ nước (HIC) là một kỹ thuật tinh chế và phân tích để tách các chất phân tích, chẳng hạn như protein, dựa trên các tương tác kỵ nước giữa chất phân tích đó và nền sắc ký. Nó có thể cung cấp một phương pháp tiếp cận trực giao không biến tính để phân tách pha đảo ngược, bảo vệ các cấu trúc ban đầu và hoạt tính tiềm năng của protein. Trong sắc ký tương tác kỵ nước, vật liệu nền được thay thế nhẹ bằng các nhóm kỵ nước. Các nhóm này có thể bao gồm từ nhóm metyl, etyl, propyl, butyl, octyl hoặc phenyl. Ở nồng độ muối cao, các sidechains không phân cực trên bề mặt của protein "tương tác" với các nhóm kỵ nước; nghĩa là, cả hai loại nhóm đều bị loại trừ bởi dung môi phân cực (hiệu ứng kỵ nước được tăng cường bằng cách tăng cường độ ion). Do đó, mẫu được áp dụng cho cột trong một bộ đệm có tính phân cực cao, điều này thúc đẩy sự liên kết của các mảng kỵ nước trên chất phân tích với pha tĩnh. Chất rửa giải thường là một dung dịch đệm có nồng độ muối giảm, nồng độ chất tẩy rửa tăng lên (làm gián đoạn các tương tác kỵ nước) hoặc thay đổi độ pH. Quan trọng nhất là loại muối được sử dụng, với nhiều muối kosmotropic hơn như được xác định bởi loạt Hofmeister cung cấp nhiều nước nhất có cấu trúc xung quanh phân tử và tạo ra áp suất kỵ nước. Amoni sunfat thường được sử dụng cho mục đích này. Việc bổ sung dung môi hữu cơ hoặc các thành phần ít phân cực khác có thể hỗ trợ cải thiện độ phân giải.
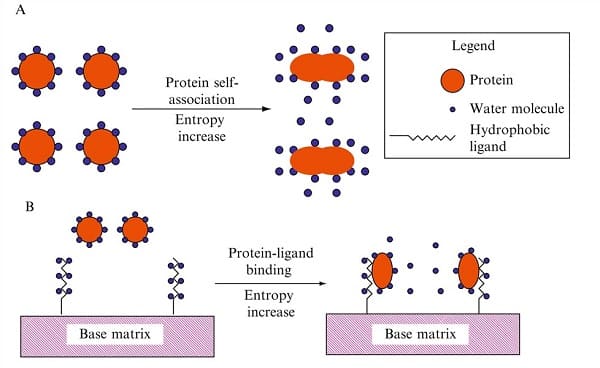
Biểu đồ phương pháp sắc ký tương tác kỵ nước
Nói chung, sắc ký tương tác kỵ nước (HIC) có lợi nếu mẫu nhạy cảm với sự thay đổi pH hoặc dung môi khắc nghiệt thường được sử dụng trong các loại sắc ký khác nhưng nồng độ muối không cao. Thông thường, đó là lượng muối trong đệm thay đổi. Năm 2012, Müller và Franzreb đã mô tả tác động của nhiệt độ lên HIC bằng cách sử dụng Bovine Serum Albumin (BSA) với bốn loại nhựa kỵ nước khác nhau. Nghiên cứu đã thay đổi nhiệt độ để ảnh hưởng đến ái lực liên kết của BSA lên chất nền. Người ta kết luận rằng nhiệt độ chu kỳ từ 50 đến 10 độ sẽ không đủ để rửa sạch hiệu quả tất cả BSA khỏi ma trận nhưng có thể rất hiệu quả nếu cột chỉ được sử dụng một vài lần. Sử dụng nhiệt độ để tác động đến sự thay đổi cho phép các phòng thí nghiệm cắt giảm chi phí mua muối.
Nếu muốn tránh nồng độ muối cao cùng với sự dao động nhiệt độ, bạn có thể sử dụng chất kỵ nước hơn để cạnh tranh với mẫu của bạn để rửa giải. Cái gọi là phương pháp độc lập với muối này của HIC đã cho thấy sự phân lập trực tiếp của Human Immunoglobulin G (IgG) từ huyết thanh với sản lượng đạt yêu cầu và sử dụng Beta-cyclodextrin làm đối thủ cạnh tranh để thay thế IgG khỏi chất nền. Điều này phần lớn mở ra khả năng sử dụng HIC với các mẫu nhạy cảm với muối vì chúng ta biết rằng nồng độ muối cao sẽ làm kết tủa protein.
9.3. Phương pháp sắc ký thủy động lực học (Hydrodynamic chromatography)
Sắc ký thủy động lực học (HDC) bắt nguồn từ hiện tượng quan sát được là các giọt lớn chuyển động nhanh hơn các giọt nhỏ. Trong một cột, điều này xảy ra vì tâm khối của các giọt lớn hơn bị ngăn gần với các cạnh của cột như các giọt nhỏ hơn vì kích thước tổng thể lớn hơn của chúng. Các giọt lớn hơn sẽ rửa giải đầu tiên từ giữa cột trong khi các giọt nhỏ hơn dính vào các cạnh của cột và rửa giải sau cùng. Dạng sắc ký này rất hữu ích để tách các chất phân tích theo khối lượng mol, kích thước, hình dạng và cấu trúc khi được sử dụng kết hợp với máy dò tán xạ ánh sáng, máy đo độ nhớt và máy đo khúc xạ. Hai loại HDC chính là dạng ống hở và dạng cột đóng gói. Ống hở cung cấp thời gian phân tách nhanh chóng cho các hạt nhỏ, trong khi cột HDC đóng gói có thể tăng độ phân giải và phù hợp hơn với các hạt có khối lượng phân tử trung bình lớn hơn 105 dalton. HDC khác với các loại sắc ký khác vì sự phân tách chỉ diễn ra trong thể tích kẽ - thể tích bao quanh và giữa các hạt trong một cột được đóng gói.
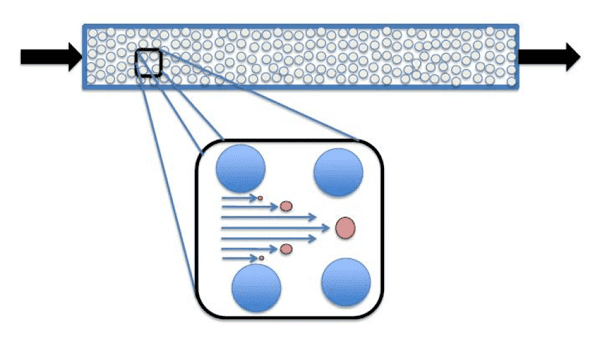
Biểu đồ phương pháp sắc ký thủy động lực học
HDC chia sẻ cùng một thứ tự rửa giải như Sắc ký loại trừ kích thước (SEC) nhưng hai quy trình vẫn khác nhau theo nhiều cách. Trong một nghiên cứu so sánh hai loại phân tách, Isenberg, Brewer, Côté và Striegel sử dụng cả hai phương pháp để xác định đặc tính polysaccharide và kết luận rằng HDC kết hợp với tán xạ ánh sáng đa giác (multiangle light scattering - MALS) đạt được sự phân bố khối lượng mol chính xác hơn khi so sánh với MALS ngoại tuyến hơn SEC trong thời gian ngắn hơn đáng kể. Điều này phần lớn là do SEC là một kỹ thuật phá hủy hơn vì các lỗ rỗng trong cột làm suy giảm chất phân tích trong quá trình tách, có xu hướng ảnh hưởng đến sự phân bố khối lượng. Tuy nhiên, nhược điểm chính của HDC là độ phân giải pic của chất phân tích thấp, điều này làm cho SEC trở thành một lựa chọn khả thi hơn khi được sử dụng với các hóa chất không dễ phân hủy và không quan trọng việc rửa giải nhanh.
HDC đóng một vai trò đặc biệt quan trọng trong lĩnh vực vi chất lỏng. Bộ máy thành công đầu tiên cho hệ thống HDC trên chip được đề xuất bởi Chmela, et al. vào năm 2002. Thiết kế của họ có thể đạt được sự phân tách bằng cách sử dụng kênh dài 80 mm trên thang thời gian 3 phút cho các hạt có đường kính từ 26 đến 110 nm, nhưng các tác giả bày tỏ cần phải cải thiện các thông số lưu giữ và phân tán. Trong một ấn phẩm năm 2010 của Jellema, Markesteijn, Westerweel và Verpoorte, việc triển khai HDC với dòng hai chiều tuần hoàn dẫn đến phân tách dựa trên kích thước, độ phân giải cao chỉ với một kênh dài 3 mm. Việc có một kênh ngắn và độ phân giải cao như vậy được xem là đặc biệt ấn tượng khi các nghiên cứu trước đây sử dụng các kênh có chiều dài 80 mm. Đối với một ứng dụng sinh học vào năm 2007, Huh, et al. đã đề xuất một thiết bị phân loại vi lỏng dựa trên HDC và trọng lực, rất hữu ích để ngăn chặn các hạt nguy hiểm tiềm tàng có đường kính lớn hơn 6 micron xâm nhập vào máu khi tiêm chất cản quang trong siêu âm. Nghiên cứu này cũng tạo ra những tiến bộ về tính bền vững môi trường trong chất lỏng vi lỏng do thiếu các thiết bị điện tử bên ngoài thúc đẩy dòng chảy, đây là một lợi thế của việc sử dụng thiết bị dựa trên trọng lực.
9.4. Phương pháp sắc ký hai chiều (Two-dimensional chromatography)
Trong một số trường hợp, độ chọn lọc được cung cấp bởi việc sử dụng một cột có thể không đủ để cung cấp độ phân giải của chất phân tích trong các mẫu phức tạp. Sắc ký hai chiều nhằm mục đích tăng độ phân giải của các pic này bằng cách sử dụng cột thứ hai có các đặc tính lý hóa khác nhau. Vì cơ chế lưu giữ trên giá đỡ rắn mới này khác với sự phân tách theo chiều thứ nhất, nên có thể tách các hợp chất bằng sắc ký hai chiều mà không thể phân biệt được bằng sắc ký một chiều. Hơn nữa, sự phân tách trên chiều thứ hai xảy ra nhanh hơn so với chiều thứ nhất. Một ví dụ về tách TLC hai chiều là nơi mẫu được chấm ở một góc của đĩa vuông, được khai triển làm khô trong không khí, sau đó quay 90 ° và thường được phát triển lại trong hệ dung môi thứ hai. Sắc ký hai chiều có thể được áp dụng cho phân tách GC hoặc LC. Phương pháp phân tách này cũng có thể được sử dụng trong cách tiếp cận cắt đứt trái tim, trong đó các vùng quan tâm cụ thể trên chiều thứ nhất được chọn để tách theo chiều thứ hai, hoặc theo cách tiếp cận toàn diện, trong đó tất cả các chất phân tích từ kích thước thứ nhất trải qua quá trình phân tách theo chiều thứ hai.
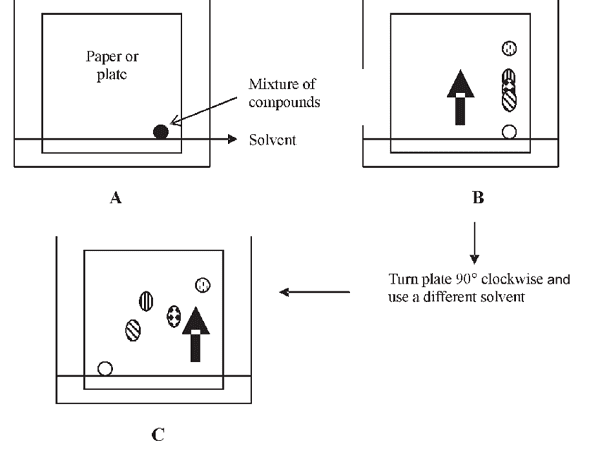
Biểu đồ phương pháp sắc ký hai chiều
9.5. Phương pháp sắc ký tầng chuyển động mô phỏng (Simulated moving-bed chromatography)
Kỹ thuật mô phỏng tầng chuyển động (simulated moving bed - SMB) là một biến thể của sắc ký lỏng hiệu năng cao; nó được sử dụng để tách các hạt và các hợp chất hóa học khó hoặc không thể phân giải bằng cách khác. Sự phân tách gia tăng này được tạo ra bởi sự sắp xếp van và cột được sử dụng để kéo dài pha tĩnh vô thời hạn. Trong kỹ thuật tầng di chuyển của sắc ký điều chế, việc nhập liệu và thu hồi chất phân tích diễn ra đồng thời và liên tục, nhưng vì những khó khăn thực tế với tầng di chuyển liên tục, kỹ thuật tầng di chuyển mô phỏng đã được đề xuất. Trong kỹ thuật mô phỏng tầng, vị trí đầu vào của mẫu và các vị trí thoát ra của chất phân tích được di chuyển liên tục, tạo cảm giác như một tầng chuyển động. Sắc ký tầng chuyển động thực (True moving bed chromatography - TMBC) chỉ là một khái niệm lý thuyết. Mô phỏng của nó, SMBC đạt được bằng cách sử dụng nhiều cột nối tiếp và bố trí van phức tạp, cung cấp cho nguồn cấp mẫu và dung môi, cũng như chất phân tích và chất thải cất cánh tại các vị trí thích hợp của bất kỳ cột nào, nhờ đó nó cho phép chuyển đổi theo các khoảng thời gian đều đặn lối vào mẫu theo một hướng, lối vào dung môi theo hướng ngược lại, đồng thời thay đổi vị trí của chất phân tích và chất thải một cách thích hợp.
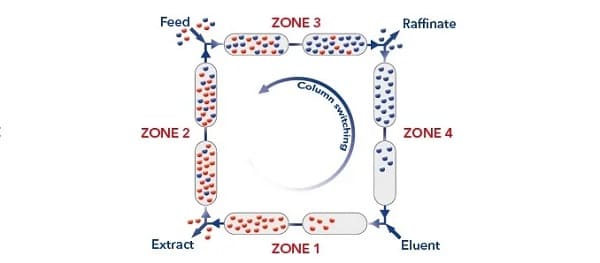
Biểu đồ phương pháp sắc ký tầng chuyển động mô phỏng
9.6. Phương pháp sắc ký khí nhiệt phân (Pyrolysis gas chromatography)
Nhiệt phân - sắc ký khí - khối phổ là một phương pháp phân tích hóa học trong đó mẫu được nung nóng để phân hủy tạo ra các phân tử nhỏ hơn được phân tách bằng sắc ký khí và được phát hiện bằng phương pháp khối phổ.
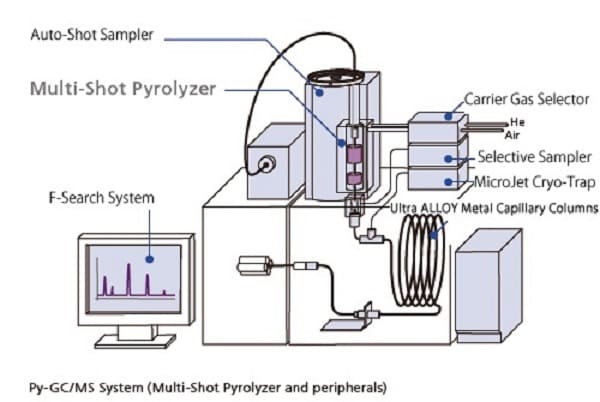
Biểu đồ phương pháp sắc ký khí nhiệt phân
Nhiệt phân là sự phân hủy nhiệt của vật liệu trong môi trường trơ hoặc chân không. Mẫu được đưa vào tiếp xúc trực tiếp với dây bạch kim hoặc đặt trong ống mẫu bằng thạch anh và được gia nhiệt nhanh chóng đến 600-1000°C. Tùy thuộc vào ứng dụng, nhiệt độ cao hơn cũng được sử dụng. Ba kỹ thuật gia nhiệt khác nhau được sử dụng trong các lò nhiệt phân thực tế: Lò nung đẳng nhiệt, gia nhiệt cảm ứng (dây tóc Curie Point) và gia nhiệt điện trở sử dụng dây tóc bạch kim. Các phân tử lớn phân cắt ở những điểm yếu nhất của chúng và tạo ra các mảnh nhỏ hơn, dễ bay hơi hơn. Các mảnh này có thể được tách ra bằng phương pháp sắc ký khí. Sắc ký đồ GC nhiệt phân thường phức tạp vì một loạt các sản phẩm phân hủy khác nhau được hình thành. Dữ liệu có thể được sử dụng làm dấu vân tay để chứng minh danh tính vật liệu hoặc dữ liệu GC/MS được sử dụng để xác định các mảnh riêng lẻ nhằm thu được thông tin cấu trúc. Để tăng tính bay hơi của các mảnh phân cực, có thể thêm các thuốc thử metyl hóa khác nhau vào mẫu trước khi nhiệt phân.
Bên cạnh việc sử dụng thiết bị nhiệt phân chuyên dụng, GC nhiệt phân của các mẫu rắn và lỏng có thể được thực hiện trực tiếp bên trong các kim phun Thiết bị hóa hơi nhiệt độ có thể lập trình (PTV) cung cấp khả năng làm nóng nhanh (lên đến 30°C/s) và nhiệt độ tối đa cao 600-650°C. Điều này là đủ cho một số ứng dụng nhiệt phân. Ưu điểm chính là không phải mua dụng cụ chuyên dụng và có thể thực hiện quá trình nhiệt phân như một phần của phân tích GC thông thường. Trong trường hợp này, phải sử dụng lớp lót đầu vào bằng thạch anh GC. Dữ liệu định lượng có thể được thu thập và kết quả tốt của quá trình tạo dẫn xuất bên trong bộ phun PTV cũng được công bố.
9.7. Phương pháp sắc ký lỏng protein nhanh (Fast protein liquid chromatography)
Sắc ký lỏng protein nhanh (FPLC) là một dạng sắc ký lỏng thường được sử dụng để phân tích hoặc tinh chế hỗn hợp của protein. Cũng như trong các dạng sắc ký khác, có thể phân tách vì các thành phần khác nhau của hỗn hợp có ái lực khác nhau đối với hai vật liệu, chất lỏng chuyển động (pha động) và chất rắn xốp (pha tĩnh). Trong FPLC, pha động là một dung dịch nước, hoặc "chất đệm". Tốc độ dòng chảy của đệm được kiểm soát bởi một máy bơm dịch chuyển tích cực và thường được giữ không đổi, trong khi thành phần của đệm có thể thay đổi bằng cách hút chất lỏng theo các tỷ lệ khác nhau từ hai hoặc nhiều bể chứa bên ngoài. Pha tĩnh là một loại nhựa bao gồm các hạt, thường là agarose liên kết chéo, được đóng gói trong một cột thủy tinh hoặc nhựa hình trụ.
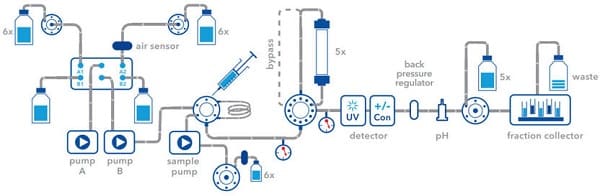
Biểu đồ phương pháp sắc ký lỏng protein nhanh
9.10. Các kỹ thuật sắc ký ngược dòng (Countercurrent chromatography)
Sắc ký đối dòng (CCC) là một loại sắc ký lỏng, trong đó cả pha tĩnh và pha động đều là chất lỏng và pha tĩnh lỏng được giữ lại bởi một lực ly tâm mạnh.
9.10.1. Phương pháp sắc ký phản dòng thủy động lực học (Hydrodynamic countercurrent chromatography)
Nguyên tắc hoạt động của thiết bị sắc ký phản dòng thủy động lực học (CCC) yêu cầu một cột bao gồm một ống hở được cuộn quanh suốt chỉ. Suốt chỉ được quay theo chuyển động hồi chuyển hai trục, điều này gây ra trường trọng lực thay đổi (G) tác động lên cột trong mỗi lần quay. Chuyển động này làm cho cột nhìn thấy một bước phân vùng trên mỗi vòng quay và các thành phần của mẫu tách biệt trong cột do hệ số phân vùng của chúng giữa hai pha lỏng không thể trộn lẫn được sử dụng. Có rất nhiều loại CCC hiện nay. Chúng bao gồm HSCCC (CCC tốc độ cao) và HPCCC (CCC hiệu suất cao). HPCCC là phiên bản mới nhất và hoạt động tốt nhất của thiết bị đo đạc hiện có.
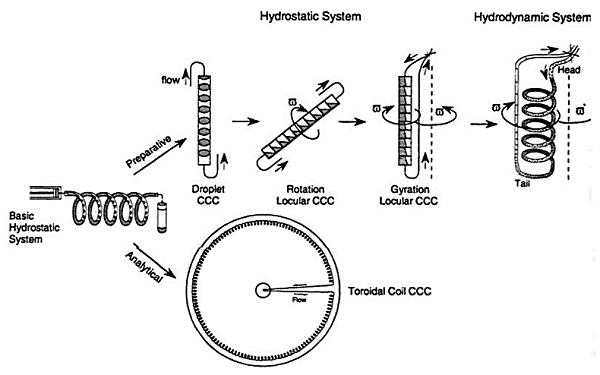
Biều đồ phương pháp sắc ký phản dòng thủy động lực học
9.10.2. Phương pháp sắc ký phân vùng ly tâm (Centrifugal partition chromatography)
Trong dụng cụ CPC (sắc ký phân vùng ly tâm hoặc sắc ký phản dòng thủy tĩnh), cột bao gồm một loạt các ô được nối với nhau bằng các ống dẫn gắn với rotor. Rotor này quay trên trục trung tâm của nó tạo ra trường ly tâm cần thiết để giữ pha tĩnh tại chỗ. Quá trình phân tách trong CPC chỉ được điều chỉnh bởi sự phân chia các chất hòa tan giữa pha tĩnh và pha động, cơ chế này có thể dễ dàng được mô tả bằng cách sử dụng hệ số phân vùng (KD) của các chất hòa tan. Dụng cụ CPC có sẵn trên thị trường để phân tách trong phòng thí nghiệm, thí điểm và quy mô công nghiệp với các kích thước cột khác nhau, từ thể tích khoảng 10 ml đến 10 lít.

Biểu đồ phương pháp sắc ký phân vùng ly tâm
9.11. Kỹ thuật sắc ký phản dòng định kỳ (Periodic counter-current chromatography)
Trái ngược với sắc ký dòng phản, sắc ký phản dòng tuần hoàn (PCC) sử dụng pha tĩnh rắn và chỉ pha động lỏng. Do đó, nó tương tự hơn nhiều so với sắc ký ái lực thông thường hơn là để chống lại sắc ký hiện tại. PCC sử dụng nhiều cột, mà trong giai đoạn tải được kết nối thẳng hàng. Chế độ này cho phép quá tải cột đầu tiên trong loạt sản phẩm này mà không làm mất sản phẩm vốn đã xuyên qua cột trước khi nhựa bão hòa hoàn toàn. Sản phẩm đột phá được ghi lại trên các cột tiếp theo. Trong bước tiếp theo, các cột được ngắt kết nối với nhau. Cột đầu tiên được rửa và rửa giải, trong khi các cột khác vẫn đang được tải. Khi cột đầu tiên (ban đầu) được cân bằng lại, nó được đưa lại vào luồng tải, nhưng là cột cuối cùng. Sau đó, quá trình tiếp tục diễn ra theo chu kỳ.
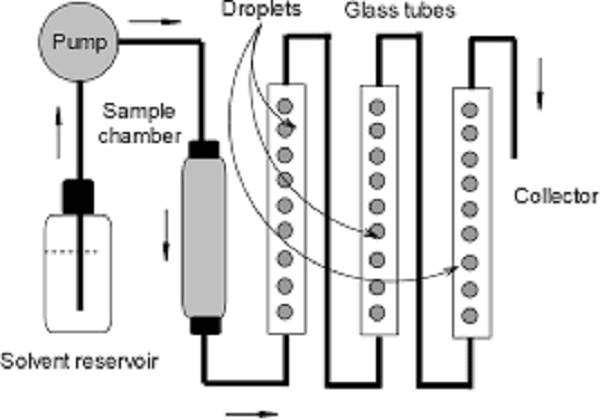
Biểu đồ kỹ thuật sắc ký phản dòng định kỳ
9.12. Phương pháp sắc ký chiral (Chiral chromatography)
Sắc ký chiral liên quan đến việc tách các đồng phân lập thể. Trong trường hợp các chất đối quang, chúng không có sự khác biệt về hóa học hoặc vật lý ngoài việc là hình ảnh phản chiếu ba chiều. Phương pháp sắc ký thông thường hoặc các quy trình phân tách khác không có khả năng tách chúng. Để cho phép xảy ra sự phân tách bất đối xứng, bản thân pha động hoặc pha tĩnh phải được tạo thành bất đối xứng, tạo ra các ái lực khác nhau giữa các chất phân tích. Các cột HPLC sắc ký không đối xứng (với pha tĩnh bất đối xứng) ở cả pha bình thường và pha đảo đều có bán trên thị trường.

Biểu đồ phương pháp sắc ký chiral
9.13. Phương thức sắc ký pha thường trong nước (Aqueous normal-phase chromatography)
Sắc ký pha bình thường nước (ANP) được đặc trưng bởi hoạt động rửa giải của chế độ pha bình thường cổ điển (nghĩa là trong đó pha động ít phân cực hơn đáng kể so với pha tĩnh) trong đó nước là một trong những thành phần của hệ dung môi pha động. Nó được phân biệt với sắc ký lỏng tương tác ưa nước (HILIC) ở chỗ cơ chế lưu giữ là do hấp phụ chứ không phải do phân vùng.
Biểu đồ phương thức sắc ký pha thường trong nước
10. Ứng dụng của sắc ký
Sắc ký được sử dụng trong nhiều lĩnh vực bao gồm công nghiệp dược phẩm, công nghiệp thực phẩm và đồ uống, công nghiệp hóa chất, khoa học pháp y, phân tích môi trường và bệnh viện.




































![[VIDEO] Hội thảo “Chất lượng nước – Những kỹ thuật mới nhất trong đảm bảo và kiểm soát chất lượng”](/resize/363/thu-vien-anh/hoi-thao-chat-luong-nuoc-vinalab-jaima-2024-12x363x4.jpg)


